- NERVEUX (SYSTÈME) - Propriétés élémentaires du neurone
- NERVEUX (SYSTÈME) - Propriétés élémentaires du neuroneLa vie du neurone adulte, comme celle de toute cellule, dépend d’un métabolisme d’entretien. Celui-ci, grand consommateur d’oxygène et de glucose, est à la base du maintien de concentrations constantes d’ions K+ et Na+ à l’intérieur du neurone, grâce à un mécanisme de transports actifs luttant contre la diffusion passive de ces ions à travers la membrane cellulaire. En outre, il assure les biosynthèses qui renouvellent sans cesse le neuroplasme, entretenant un flux cellulifuge lent (1 mm/j) de protéines le long de l’axone.Un métabolisme de croissance est en jeu dans la neurogenèse et dans la régénération, et, à cet égard, on a mis en évidence (R. Lévi-Montalcini) l’intervention d’une protéine spécifique, dite «facteur nerveux de croissance» (NGF).Enfin, la vie fonctionnelle du neurone, conséquence directe de son excitabilité (et la seule dont il sera question ici), repose sur un métabolisme d’excitation. En bref, cette vie fonctionnelle du neurone consiste à coder et à transporter de l’information ; et ce sont avant tout les prolongements du neurone – dendrites et surtout axone – qui sont les supports de cette fonction. Or, les axones, détachés de leur cellule et isolés dans un milieu convenable, peuvent survivre plusieurs heures, et c’est en fait d’abord sur des segments de nerf puis sur des axones isolés par microdissection que les expérimentateurs travaillèrent et déterminèrent avec une précision croissante les propriétés élémentaires du neurone.Par «propriétés élémentaires», les seules qui seront envisagées ici, nous entendons celles du neurone considéré isolément, indépendamment de ses connexions avec d’autres neurones ou avec des récepteurs ou des effecteurs. Limitation artificielle évidemment, puisque la principale fonction du neurone est celle qu’il assume en tant que composant d’un système de connexions et qui l’amène à transmettre son excitation à d’autres neurones ou à des cellules effectrices (muscles, glandes). Cette limitation, voulue par souci de clarté, amène à traiter ailleurs [cf. SYNAPSES] de la structure et du fonctionnement du dispositif de transmission, ou synapse , dont une partie (présynaptique) se trouve aux terminaisons des prolongements axonaux et l’autre (postsynaptique) sur les surfaces réceptrices somato-dendritiques (parfois axonales) de l’ensemble des neurones auxquels le premier transmet son excitation. La complexité et la diversité des mécanismes de transmission, les techniques particulières mises en œuvre pour les analyser justifient ce report.La physiologie du neurone détaché de ses articulations se ramènera ainsi à deux opérations fondamentales qui découlent de son excitabilité: l’émission et la conduction de ce qu’on appelle encore souvent « influx nerveux».Sur la nature de celui-ci, on se livra jadis à bien des spéculations, remplacées aujourd’hui par un ensemble de faits qui dépouillent de son mystère un des phénomènes les plus importants de la vie animale. «Influx» est un terme impropre, dans la mesure où, sans même parler d’«esprits animaux», il évoque l’image d’un fluide qui s’écoule et, par suite, distingue l’agent de son support, la fibre nerveuse, alors que c’est la fibre elle-même qui, en vertu des propriétés de sa membrane plasmique (plasmalemme, axolemme) engendre l’influx en chacun de ses points. Il ne s’agit pas non plus, comme cela fut proposé, de la propriété qu’aurait cette membrane de propager une vibration (mécanique, intramoléculaire ou électromagnétique) dont l’énergie d’initiation se dissiperait à mesure de l’éloignement.Il s’agit, en bref, d’un processus électrochimique occupant, à chaque instant, une portion limitée de la surface neuronale, et capable, lorsqu’il est assez intense, de se communiquer de proche en proche en se régénérant, l’énergie nécessaire étant empruntée aux molécules énergétiques locales.Aujourd’hui, bien que toujours utilisé, le terme d’influx nerveux est souvent remplacé par celui de potentiel d’action , son signe électrique, que sa forme fait aussi désigner comme impulsion nerveuse , neuropulsion (nerve impulse ) ou pointe (spike ). Enfin, lorsqu’on veut souligner le rôle fonctionnel de vecteur d’information de cet influx, on le nomme signal , ou message .1. Physico-chimie de l’excitation nerveuseLa propriété essentielle du neurone est d’être excitable. Les notions générales d’excitabilité et d’excitation ont déjà été exposées (cf. EXCITATION ET EXCITABILITÉ), ainsi que les processus électrogénétiques qui sont les réponses spécifiques aux stimulations (cf. ÉLECTROPHYSIOLOGIE, chap. 1 et 4). On rappellera seulement ici que le neurophysiologiste peut artificiellement déclencher une excitation nerveuse à l’aide d’un courant électrique, pourvu que celui-ci soit admis à traverser une petite portion de surface dans un sens qui dépolarise suffisamment la membrane cellulaire. L’excitabilité dépend ainsi de l’existence d’une polarisation membranaire de repos. En l’absence d’excitations, chargée positivement sur sa face externe, négativement sur sa face interne, la membrane est le siège d’un potentiel de repos (PR) de l’ordre de 70 à 100 mV, mesurable entre deux électrodes réceptrices (fig. 2, en 2).Les microtechniques adéquates de stimulation, celles de mesure et d’enregistrement des potentiels, appliquées à de grosses fibres (telles que l’axone géant de calmar) ou à des cellules d’assez grand diamètre (cellules ganglionnaires de Mollusques, neurone moteur de la moelle des Mammifères) ont permis de faire une étude biophysique approfondie des propriétés de la membrane pendant que se déroule le processus d’excitation. La mesure à voltage fixe imposé (voltage clamp ) de la conductance de la membrane révèle la cause directe du potentiel d’action: tandis qu’à l’électrode où le courant entre dans le neurone (anode) il n’y a pas d’excitation et que la loi d’Ohm s’applique, à la cathode, au contraire, lorsque le voltage imposé est fixé au-dessus d’une valeur seuil, le courant, au lieu de sortir, entre en avalanche comme si la résistance était devenue négative. Autrement dit, une force électromotrice se trouve démasquée, qui engendre son propre courant, selon un processus autorégénératif qui va jusqu’au bout de ses possibilités, d’où la loi dite du « tout ou rien », et l’existence d’une période concomitante d’inexcitabilité, ou «période réfractaire absolue». Avec les fibres myélinisées des nerfs de Vertébrés, la pointe de potentiel ne dure pas plus de 0,5 à 2 millièmes de seconde (fig. 2).L’école de Cambridge (A. L. Hodgkin et A. F. Huxley), prenant comme point de départ le fait que le courant contrariant disparaît lorsque le milieu extérieur a été privé d’ions sodium, a élaboré une théorie ionique de ces phénomènes, appuyée sur de nombreux autres faits. Les ions Na+ et K+ y ont un rôle prédominant (fig. 3). Cette théorie, aujourd’hui célèbre (cf. ÉLECTROPHYSIOLOGIE, chap. 1), est complétée par une interprétation de la phase de retour à l’état initial faisant appel à une dépense d’énergie chimique pour actionner les deux « pompes », l’une à Na+ l’autre à K+ qui, couplées, rétablissent l’équilibre ionique primitif. L’énergie est empruntée à des processus métaboliques de plus en plus lents, créant une chaîne de réactions depuis la décomposition de produits phosphorés riches en énergie, adénosine-triphosphate (ATPADP), puis créatine-phosphate, jusqu’au cycle de la glycolyse et aux processus d’oxydation: en activité maximale, un nerf consomme deux fois plus d’oxygène qu’au repos. Parallèlement, on met en évidence un dégagement initial de chaleur (lié sans doute au remaniement membranaire), suivi d’un refroidissement et, enfin, d’une «chaleur tardive», pendant la phase de récupération. Parmi les enzymes qui agissent aux différentes étapes de ce métabolisme complexe, l’ATPase membranaire jouerait un rôle prédominant auquel participerait de façon étroite l’ion calcium. Il est bien connu, d’ailleurs, que l’appauvrissement en ions Ca++ rend le neurone hyperexcitable, et inversement que leur excès stabilise la membrane plasmique qui délimite extérieurement la cellule nerveuse et ses prolongements.Que se passe-t-il dans cette membrane de 7,5 nm (moins de un centième de micromètre), lorsqu’elle se dépolarise sous l’effet d’une stimulation? C’est, en fin de compte, la question primordiale. De telles membranes sont formées d’une palissade bimoléculaire de nature lipidique sur laquelle sont appliquées deux couches de protéines. Celles de la couche la plus interne, sous l’influence de la dépolarisation, changeraient rapidement (10-4 s) de conformation, ce qui entraînerait un réarrangement des molécules lipidiques de telle sorte que les passages (pores) réservés aux transits ioniques se multiplieraient ou s’agrandiraient [cf. MEMBRANES CELLULAIRES]. Ainsi s’expliquerait l’accroissement soudain de la perméabilité ionique au Na+, puis au K+. Le premier effet du courant serait de déplacer des ions Ca++ liés à une ATPase. La protéine «électrogénique» pourrait être justement celle qui confère sa spécificité à cette enzyme. Telle est l’hypothèse qui paraît défendable en 1971 (C. J. Ouneau, 1967).L’excitation électrique, en fonction des paramètres temporels du courant, étudiée autrefois uniquement sur les fibres myélinisées, avait inspiré des «lois de l’excitabilité», dont on sait aujourd’hui qu’elles ne s’appliquent pas aux fibres amyéliniques ou aux structures somato-dendritiques. Ces lois disaient notamment que le nerf ne pouvait répondre qu’à une variation brusque du courant (excitation de fermeture ou d’ouverture) et n’y répondait que par un seul potentiel d’action. Or, cela est dû à des phénomènes d’atténuation physique du courant (polarisation des gaines) et à des réactions complexes, dites d’accommodation physiologique, qui dépendent en partie des conditions artificielles de la stimulation. Ces particularités sont interprétées aujourd’hui comme dues à des effets secondaires masquant dans les fibres myélinisées une tendance générale du neurone à la réponse répétée (dite aussi «répétitive» ou «auto-rythmique»), lorsqu’une dépolarisation s’y maintient. En fait, c’est cette décharge cadencée de potentiels d’action, ou trains d’impulsions , qui représente le type fondamental d’activité fonctionnelle du neurone. Les rythmes naturels vont de quelques impulsions à quelques centaines par seconde et sont grandement influencés par les variations de température, comme le laisse prévoir leur dépendance vis-à-vis des processus biochimiques du métabolisme (fig. 4).L’excitabilité électrique n’est pas uniformément distribuée sur toutes les parties du même neurone. Le segment intermédiaire (S.I.) [cf. système NERVEUX - Le tissu nerveux, fig. 2], au point de départ de l’axone, est la région dont le seuil est le plus bas. Certains auteurs affirment, de leur côté, que les dendrites et une partie, au moins, du corps cellulaire sont électriquement inexcitables, et que l’onde de dépolarisation ne s’y propage que de façon «décrémentielle» (c’est-à-dire en s’amenuisant peu à peu). Toutes les études précises qui ont pu être faites sur le sujet ont, en tout cas, révélé la diversité régionale de l’excitabilité (électrique ou chimique) et des propriétés électrogénétiques du neurone, chaque type de neurone pouvant avoir, à cet égard, ses particularités.2. L’émission naturelle de l’influx nerveuxCe qui vient d’être dit permet de comprendre que, dans les conditions naturelles de fonctionnement, c’est en général au niveau du segment intermédiaire (S.I.) que l’influx nerveux prend naissance, sous l’influence des actions dépolarisantes que subit sa membrane plasmique. D’où viennent donc ces actions? On peut en distinguer cinq sortes:– Lorsqu’un neurone est, comme cela arrive souvent, bombardé incessamment sur son arbre dendritique et sur son soma par des influx provenant d’autres neurones, il existe, à chaque instant, un bilan des dépolarisations et des surpolarisations, somme algébrique des potentiels postsynaptiques d’excitation et des potentiels postsynaptiques d’inhibition (cf. fig. 11, in ÉLECTROPHYSIOLOGIE). Le S.I., placé en un point du champ électrique résultant, voit sa membrane réagir à ce bilan en fonction de l’intensité et de la direction du flux de courant qui la traverse. En quelque sorte, centre intégrateur de ces activités afférentes, le S.I. manifeste cette propriété en devenant centre émetteur , du moins aussi longtemps qu’une dépolarisation supraliminaire y prédomine: activité de pacemaker qui engendre des trains d’impulsions à cadence modulée et plus ou moins durables (fig. 5). Si les facteurs de cette modulation restent implicites, on dira, abusivement sans doute, que le neurone est «auto-actif», et que sa décharge est spontanée.– Il arrive, dans les conditions naturelles comme dans la stimulation artificielle, qu’une variation nette de cadence – éventuellement la naissance d’un train d’impulsions à partir du silence – soit explicitement imputable à l’impact, sur les synapses du neurone étudié, d’influx ayant emprunté des voies bien identifiées: on dira alors qu’il s’agit d’une véritable transmission synaptique de l’excitation. Que l’on comprenne bien que le processus n’est pas essentiellement différent du précédent, et que l’on bannisse l’expression trompeuse de «transmission d’influx». Dans les deux cas, l’influx (c’est-à-dire les trains d’impulsions) n’est pas «transmis»: il est ré-émis , avec des caractéristiques qui dépendent autant des propriétés locales de la zone d’émission (trigger zone ) que du champ électrique créé par l’ensemble des potentiels postsynaptiques.– Dans le cas d’un neurone sensitif primaire, le mécanisme d’émission est analogue, sauf que la zone d’émission n’est plus située près du soma, mais non loin de la terminaison réceptrice et que le potentiel générateur résulte d’une transduction , c’est-à-dire d’une utilisation de l’énergie spécifique du stimulus (lumineux, sonore, etc.) pour déclencher un phénomène électrique dépolarisant.– Des effets secondaires de nature électrique sur le rythme d’émission se produisent du fait que le neurone se trouve nécessairement plongé dans le champ électrique tissulaire général, dû à des facteurs complexes, parmi lesquels les champs locaux dépendant de l’activité des neurones voisins [cf. ÉLECTROPHYSIOLOGIE]. Il peut en résulter des effets d’entraînement et de synchronisation qui forcent le neurone à une activité collective extrasynaptique et généralement anormale. C’est ce qui paraît avoir lieu, par exemple, dans l’empoisonnement par la strychnine, et dans la grande crise épileptique.– Enfin, beaucoup plus important sans doute qu’on ne l’admet habituellement est le cas où le neurone, aidé ou non par des afférences synaptiques, engendre lui-même son propre rythme, en vertu de sa cinétique métabolique. C’est alors que l’on peut vraiment parler d’auto-activité , ce qui ne veut pas dire que le phénomène ne doive rien aux conditions, notamment chimiques, que lui impose le milieu extra-cellulaire (telle composition ionique, hormones circulantes, éventuellement drogues).L’étude électrophysiologique des variations du potentiel de membrane au lieu même de l’émission a révélé deux modalités cinétiques d’autorythmicité (fig. 5 et 6). L’une d’elles est du type nommé en physique oscillation de relaxation ; elle se manifeste après chaque pointe P par une onde de surpolarisation (potentiel positif) qui reflète le processus de restauration R, mais qui, au lieu d’atteindre le niveau d’équilibre, s’infléchit et se continue par une onde accélérée de dépolarisation excitatrice E, génératrice à son tour d’une pointe, et ainsi de suite. Une démultiplication de fréquence, à la moitié ou au quart, s’observe parfois dans ces cas. L’autre modalité est du type quasi sinusoïdal avec une périodicité plus ou moins régulière et une large marge de fréquences; ces ondes lentes , comme on les nomme, apparaissent souvent en synchronisme dans une population de neurones et sont, sans doute, les composantes des rythmes cérébraux classiques (cf. ÉLECTROPHYSIOLOGIE, chap. 2). Lorsque, dans un neurone, au niveau de son segment initial, elles produisent une dépolarisation supraliminaire, elles donnent naissance à une auto-activité rythmique du premier type, qui s’y superpose. Ainsi apparaissent les décharges «en bouffées» (fig. 5), ayant souvent dans les centres nerveux un rôle fonctionnel normal ou, en neurologie, une signification symptomatologique d’un certain intérêt.3. La conduction de l’influx nerveuxDès 1850, H. von Helmholtz avait mesuré indirectement une vitesse d’influx nerveux, en comparant les délais pour une secousse musculaire provoquée en stimulant successivement deux points, distants de quelques centimètres, du nerf qui la commandait. C’était sur le nerf sciatique d’une grenouille, et il annonça 25 m/s. On trouverait à peu près la même valeur aujourd’hui, au moyen d’enregistrements de potentiels d’action, avec des temps précisés à moins de 10-4 s. Née en n’importe quel point d’un nerf par stimulation artificielle, l’onde de potentiel d’action se propage rapidement dans les deux sens, mais le parcours naturel est celui qui va de la zone d’émission vers la destination fonctionnelle du signal électrique: il est appelé «orthodromique». L’autre est «antidromique» (fig. 1 et 2).Mécanisme de la conductionL’idée que cette propagation – nommée «conduction» pour la distinguer de celle que réalise la transmission synaptique – pourrait s’expliquer par une réexcitation de proche en proche due au courant d’action lui-même fut suggérée sous le nom de théorie du circuit local par le physiologiste allemand L. Hermann (1899). Elle ne fut définitivement fondée et admise qu’après les travaux de A. L. Hodgkin (1937). Auparavant, le Japonais G. Kato (1924) avait apporté des arguments pour renforcer la notion, alors combattue, que la conduction dans les fibres individuelles implique la loi du « tout ou rien », et est aussi non décrémentielle. Dès qu’on put travailler directement sur des fibres isolées, une étude biophysique précise révéla que le même phénomène apparaissait sous trois aspects fondamentaux (fig. 7).Le mécanisme proprement dit de la conduction le long d’un axone s’explique simplement en termes physiques par le rapprochement de trois propriétés: l’excitabilité électrique, le potentiel d’action P et la structure de câble de l’axone. En utilisant les mêmes notations que précédemment, on peut schématiser les relations de la façon suivante:
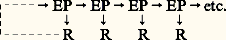 Le premier graphisme (extrémité gauche) symbolise une région d’émission autorythmique, et les flèches figurent l’extension que la structure de câble permet de donner aux lignes de courant. Cette représentation fait comprendre que la phase chimique R de restauration n’est pas directement liée à la chaîne causale de la conduction, ce qui explique pourquoi la vitesse de l’influx varie moins avec la température qu’on ne l’attendrait d’un système fortement contrôlé par le métabolisme.L’assimilation de la fibre à un câble vient de ce qu’elle est constituée par un filet d’axoplasme relativement conducteur enveloppé d’un axolemme résistant, malgré sa minceur (face=F0019 礪 2 000 行 憐 cm2), sauf au moment du potentiel d’action, et doué d’une notable capacité (de l’ordre de 1 猪m F/cm2). Le modèle d’un tel système est bien représenté par la figure 8, et il est facile de comprendre que, lorsqu’un de ses points est mis à un potentiel V0, un courant s’y distribue de telle sorte que les potentiels des points voisins s’atténuent selon une loi exponentielle en fonction de la distance, soit:
Le premier graphisme (extrémité gauche) symbolise une région d’émission autorythmique, et les flèches figurent l’extension que la structure de câble permet de donner aux lignes de courant. Cette représentation fait comprendre que la phase chimique R de restauration n’est pas directement liée à la chaîne causale de la conduction, ce qui explique pourquoi la vitesse de l’influx varie moins avec la température qu’on ne l’attendrait d’un système fortement contrôlé par le métabolisme.L’assimilation de la fibre à un câble vient de ce qu’elle est constituée par un filet d’axoplasme relativement conducteur enveloppé d’un axolemme résistant, malgré sa minceur (face=F0019 礪 2 000 行 憐 cm2), sauf au moment du potentiel d’action, et doué d’une notable capacité (de l’ordre de 1 猪m F/cm2). Le modèle d’un tel système est bien représenté par la figure 8, et il est facile de comprendre que, lorsqu’un de ses points est mis à un potentiel V0, un courant s’y distribue de telle sorte que les potentiels des points voisins s’atténuent selon une loi exponentielle en fonction de la distance, soit: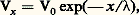 où est la constante d’espace, telle que: 2 = r m /(r i + r e ), rapport des résistances par unité de longueur de la membrane (r m , résistance transversale) et de l’intérieur de l’axone (r i , résistance longitudinale). La résistance extérieure, généralement très faible, peut être négligée. Sur la fibre myélinisée, vaut de 1 à 3 mm. La diffusion longitudinale de ce que les anciens auteurs appelaient l’«électrotonus» est donc à courte portée, mais comme le potentiel d’action dispose d’un facteur 見 de sécurité de l’ordre de 5 à 10 en excitabilité normale, sa portée réelle, dans le meilleur cas, peut approcher de 9, et, effectivement, Hodgkin a montré que l’influx peut augmenter l’excitabilité d’un petit segment situé au-delà d’un «bloc» créé par refroidissement localisé.Du fait de la capacité membranaire, la vitesse d’envahissement de l’électrotonus n’est pas instantanée. Elle dépend d’une constante de temps, 精 = r m C, de l’ordre de 0,3 ms pour les fibres à conduction rapide. On voit que lorsque le potentiel d’action entre en jeu pour dépolariser non un point, mais une petite zone de la fibre, la vitesse de l’influx doit se trouver sous la dépendance d’au moins quatre facteurs: deux d’entre eux, et 精, imposent sa vitesse d’extension à l’électrotonus, 見 sa limite longitudinale d’efficacité excitatrice, et le quatrième dépend de la cinétique propre à la montée du potentiel d’action. À cause de la haute résistivité de la myéline, la théorie du circuit local ne pouvait être valable pour les fibres myélinisées que si l’on démontrait que le courant passe pour sa plus grande partie par les étranglements de Ranvier, où la myéline fait défaut. De même, on ne pouvait concevoir le transit rapide des ions que dans ces régions où la membrane est découverte. Dans l’une de ces fibres, les étranglements (largeur = 0,5 猪m) se succèdent à peu près tous les millimètres (le segment myélinisé a 1 à 2,5 mm de long). Chaque étranglement est successivement une sortie puis une entrée de courant, tandis que les parties myélinisées, entre les étranglements, ne laissent passer que trop peu de courant pour que l’excitation soit efficace. L’influx «saute», pour ainsi dire, l’espace inutile et peut donc voyager plus vite à diamètre égal si le nerf est myélinisé que s’il ne l’est pas, tout au moins au-dessus de 1 猪m. Ce mode de propagation est désigné sous le nom de conduction saltatoire .De délicates expériences, d’abord mises au point par l’école japonaise (G. Kato, I. Tasaki), ont démontré, à partir de fibres isolées dont les étranglements étaient repérés sous le microscope, la réalité de ce mode perfectionné de conduction, en même temps qu’elles ajoutaient d’autres preuves au crédit de la théorie électrique. On travaille aujourd’hui couramment pour un seul étranglement de Ranvier, pour en recueillir l’activité électrique ou pour le soumettre à divers agents physiques ou chimiques (fig. 9).Loi des diamètresLes fibres nerveuses diffèrent beaucoup par leur diamètre, et l’on sait depuis longtemps que les fibres fines conduisent l’influx plus lentement que les grosses. Ainsi, chez les Invertébrés (fibres non myélinisées), il existe des fibres très fines (de l’ordre du micromètre) qui conduisent l’influx à une vitesse de quelques millimètres par seconde, et les vitesses de plusieurs mètres par seconde n’y sont atteintes (grandes seiches) qu’au prix de la formation de fibres géantes (brigitteemptyv; face=F0019 年 1 mm). La loi empirique est une proportionnalité de la vitesse à la racine carrée du diamètre. Or, c’est bien ce qu’indique le calcul lorsque l’on tient compte du fait que la constante d’espace est inversement proportionnelle à la racine carrée de r i (r e étant négligeable), résistance interne de la fibre qui dépend évidemment de son diamètre, tandis qu’on a tout lieu de penser que les propriétés physiques de l’enveloppe – résistance et capacité – ne diffèrent pas sensiblement d’une fibre à l’autre.Les nerfs des Vertébrés contiennent des fibres non myélinisées très fines (face=F0019 麗 1 猪) et des fibres plus grosses, toutes entourées de manchons de myéline, de résistance élevée, mais de très faible capacité à cause de leur épaisseur. Or, pour les fibres myélinisées, la relation avec le diamètre est une loi de proportionnalité. Chez les Vertébrés homéothermes, à leur température normale, il faut approximativement multiplier par six le diamètre, exprimé en micromètres, d’une fibre myélinisée pour avoir la vitesse de l’influx en mètres par seconde. Chez les animaux à sang froid, il faut tenir compte de la température car la vitesse en dépend, ce qui explique la lenteur des réactions de ces animaux (grenouilles, serpents, crocodiles) lorsqu’ils sont refroidis. La comparaison des deux relations, en tenant compte des coefficients, a montré que la loi de la racine carrée défavorise la rapidité de conduction pour les fibres de diamètre supérieur à 1 猪m (N. A. H. Rushton, 1951); or, c’est à peu près à partir du micron que la myéline commence à faire son apparition. On n’a pas tardé à comprendre pourquoi cette formation avait permis aux axones de conduire vite sans prendre autant de place que chez les Invertébrés – ce qui eût entraîné à des grosseurs de nerfs incompatibles avec le plan normal des organismes.Typologie physiologique du nerfLes nerfs des Vertébrés sont des faisceaux d’axones (cf. système NERVEUX - Le tissu nerveux, fig. 5), dont les diamètres sont plus ou moins largement distribués sur l’échelle des micromètres: les myélinisés vont de 1 à 22 猪m, et il a fallu le microscope électronique pour s’apercevoir de l’abondance, dans certains nerfs, de fibres non myélinisées qui demandent une échelle en dixièmes de micromètres. Les ondes de potentiel d’action de toutes ces fibres voyagent donc avec des vitesses fort différentes, et, si elles se trouvent lancées en même temps en un point du nerf par une stimulation électrique artificielle, on comprend qu’une électrode réceptrice placée à quelques centimètres les reçoive avec un certain décalage, qui est proportionnel à la distance. Si le nerf est assez hétérogène, son potentiel d’action global pourra prendre une forme multimodale, en relation avec son spectre de diamètres (fig. 10).C’est en constatant ce fait et en l’interprétant correctement que, en prenant le raisonnement dans l’autre sens, les Américains H. S. Gasser et J. Erlanger firent les premiers (1927) la preuve de l’existence d’une relation diamètre-vitesse. À une époque où les microtechniques de recueil de l’activité élémentaire n’étaient pas encore au point, cette preuve ainsi que la vérification d’une hypothèse sur la forme de la relation ne pouvaient être données que par des essais de reconstruction d’un potentiel d’action global à partir de ses composantes convenablement décalées. Plusieurs auteurs, H. S. Gasser et H. Grundfest (1939), J. B. Hursh (1939), entre autres, s’y employèrent avec succès.Le résultat de ces laborieuses analyses est d’autant plus intéressant qu’il conduisit à un classement des fibres en catégories présentant certains rapports avec les fonctions que les nerfs assument (fig. 11). On distingue tout d’abord trois grands types de fibres: A, B, C. Les fibres A myélinisées, catégorie très étendue au point de vue fonctionnel, comprennent, en effet, tous les afférents de la sensibilité cutanée et de la sensibilité musculaire, ainsi que les efférents de la motricité squelettique; les fibres B, également à myéline, sont les fibres préganglionnaires du système sympathique; les fibres C, amyéliniques, se divisent en deux groupes, les Cs (efférents postganglionnaires du système sympathique) et les Cr (qui accompagnent les afférents cutanés II et III dans les racines postérieures de la moelle). Le tableau 1 donne quelques-unes des caractéristiques différentielles des fibres A, B et C.Si l’on part maintenant de la grande distinction fonctionnelle entre sensibilité et motricité, on retrouve ces catégories avec des subdivisions par ordre de vitesses décroissantes, notées différemment (tabl. 2) selon Gasser (alphabet grec) ou Lloyd (chiffres romains).Les fibres des nerfs sensoriels spécialisés (nerfs optique, auditif, vestibulaire, olfactif) ne rentrent pas dans ces catégories. Il en est de même pour les voies nerveuses de la moelle et de l’encéphale.4. Le neurone, vecteur d’informationDans son rôle de vecteur d’information, le neurone considéré isolément n’est qu’un intermédiaire, de telle sorte que le problème ne saurait être abordé ici dans son ensemble (cf. CYBERNÉTIQUE - Cybernétique et biologie; SYNAPSES).La figure 12 présente schématiquement le neurone comme un système entrée-sortie, capable de coder, sous forme de trains d’impulsions de fréquence variable, l’intensité du niveau de l’excitation qui se totalise à chaque instant à son pôle récepteur. Les trains sont ensuite conduits sans altération par l’axone jusqu’à ses terminaisons ramifiées où se distribue l’information à un nombre plus ou moins grand d’autres neurones.En supposant que chaque impulsion soit isolément capable d’une opération sélective à son point d’impact (un bit par pointe), le débit maximal possible de la ligne pourrait être de quelques centaines de bits par seconde; mais l’incrément T de l’intervalle T entre deux pointes successives est probablement un symbole élémentaire de codage plus significatif, dans la mesure où il dépasse le niveau de son bruit. En prenant, pour ce dernier, 梁 0,05 ms, Mc Kay et Mc Culloch ont calculé un débit maximal de 2 900 bits/s. En appliquant leur formule à des trains de fréquence moyenne 100, on obtient 1 500 bits/s, soit 15 bits par impulsion, pour le nombre des opérations sélectives possibles au cours des opérations réalisées ensuite dans les centres nerveux.
où est la constante d’espace, telle que: 2 = r m /(r i + r e ), rapport des résistances par unité de longueur de la membrane (r m , résistance transversale) et de l’intérieur de l’axone (r i , résistance longitudinale). La résistance extérieure, généralement très faible, peut être négligée. Sur la fibre myélinisée, vaut de 1 à 3 mm. La diffusion longitudinale de ce que les anciens auteurs appelaient l’«électrotonus» est donc à courte portée, mais comme le potentiel d’action dispose d’un facteur 見 de sécurité de l’ordre de 5 à 10 en excitabilité normale, sa portée réelle, dans le meilleur cas, peut approcher de 9, et, effectivement, Hodgkin a montré que l’influx peut augmenter l’excitabilité d’un petit segment situé au-delà d’un «bloc» créé par refroidissement localisé.Du fait de la capacité membranaire, la vitesse d’envahissement de l’électrotonus n’est pas instantanée. Elle dépend d’une constante de temps, 精 = r m C, de l’ordre de 0,3 ms pour les fibres à conduction rapide. On voit que lorsque le potentiel d’action entre en jeu pour dépolariser non un point, mais une petite zone de la fibre, la vitesse de l’influx doit se trouver sous la dépendance d’au moins quatre facteurs: deux d’entre eux, et 精, imposent sa vitesse d’extension à l’électrotonus, 見 sa limite longitudinale d’efficacité excitatrice, et le quatrième dépend de la cinétique propre à la montée du potentiel d’action. À cause de la haute résistivité de la myéline, la théorie du circuit local ne pouvait être valable pour les fibres myélinisées que si l’on démontrait que le courant passe pour sa plus grande partie par les étranglements de Ranvier, où la myéline fait défaut. De même, on ne pouvait concevoir le transit rapide des ions que dans ces régions où la membrane est découverte. Dans l’une de ces fibres, les étranglements (largeur = 0,5 猪m) se succèdent à peu près tous les millimètres (le segment myélinisé a 1 à 2,5 mm de long). Chaque étranglement est successivement une sortie puis une entrée de courant, tandis que les parties myélinisées, entre les étranglements, ne laissent passer que trop peu de courant pour que l’excitation soit efficace. L’influx «saute», pour ainsi dire, l’espace inutile et peut donc voyager plus vite à diamètre égal si le nerf est myélinisé que s’il ne l’est pas, tout au moins au-dessus de 1 猪m. Ce mode de propagation est désigné sous le nom de conduction saltatoire .De délicates expériences, d’abord mises au point par l’école japonaise (G. Kato, I. Tasaki), ont démontré, à partir de fibres isolées dont les étranglements étaient repérés sous le microscope, la réalité de ce mode perfectionné de conduction, en même temps qu’elles ajoutaient d’autres preuves au crédit de la théorie électrique. On travaille aujourd’hui couramment pour un seul étranglement de Ranvier, pour en recueillir l’activité électrique ou pour le soumettre à divers agents physiques ou chimiques (fig. 9).Loi des diamètresLes fibres nerveuses diffèrent beaucoup par leur diamètre, et l’on sait depuis longtemps que les fibres fines conduisent l’influx plus lentement que les grosses. Ainsi, chez les Invertébrés (fibres non myélinisées), il existe des fibres très fines (de l’ordre du micromètre) qui conduisent l’influx à une vitesse de quelques millimètres par seconde, et les vitesses de plusieurs mètres par seconde n’y sont atteintes (grandes seiches) qu’au prix de la formation de fibres géantes (brigitteemptyv; face=F0019 年 1 mm). La loi empirique est une proportionnalité de la vitesse à la racine carrée du diamètre. Or, c’est bien ce qu’indique le calcul lorsque l’on tient compte du fait que la constante d’espace est inversement proportionnelle à la racine carrée de r i (r e étant négligeable), résistance interne de la fibre qui dépend évidemment de son diamètre, tandis qu’on a tout lieu de penser que les propriétés physiques de l’enveloppe – résistance et capacité – ne diffèrent pas sensiblement d’une fibre à l’autre.Les nerfs des Vertébrés contiennent des fibres non myélinisées très fines (face=F0019 麗 1 猪) et des fibres plus grosses, toutes entourées de manchons de myéline, de résistance élevée, mais de très faible capacité à cause de leur épaisseur. Or, pour les fibres myélinisées, la relation avec le diamètre est une loi de proportionnalité. Chez les Vertébrés homéothermes, à leur température normale, il faut approximativement multiplier par six le diamètre, exprimé en micromètres, d’une fibre myélinisée pour avoir la vitesse de l’influx en mètres par seconde. Chez les animaux à sang froid, il faut tenir compte de la température car la vitesse en dépend, ce qui explique la lenteur des réactions de ces animaux (grenouilles, serpents, crocodiles) lorsqu’ils sont refroidis. La comparaison des deux relations, en tenant compte des coefficients, a montré que la loi de la racine carrée défavorise la rapidité de conduction pour les fibres de diamètre supérieur à 1 猪m (N. A. H. Rushton, 1951); or, c’est à peu près à partir du micron que la myéline commence à faire son apparition. On n’a pas tardé à comprendre pourquoi cette formation avait permis aux axones de conduire vite sans prendre autant de place que chez les Invertébrés – ce qui eût entraîné à des grosseurs de nerfs incompatibles avec le plan normal des organismes.Typologie physiologique du nerfLes nerfs des Vertébrés sont des faisceaux d’axones (cf. système NERVEUX - Le tissu nerveux, fig. 5), dont les diamètres sont plus ou moins largement distribués sur l’échelle des micromètres: les myélinisés vont de 1 à 22 猪m, et il a fallu le microscope électronique pour s’apercevoir de l’abondance, dans certains nerfs, de fibres non myélinisées qui demandent une échelle en dixièmes de micromètres. Les ondes de potentiel d’action de toutes ces fibres voyagent donc avec des vitesses fort différentes, et, si elles se trouvent lancées en même temps en un point du nerf par une stimulation électrique artificielle, on comprend qu’une électrode réceptrice placée à quelques centimètres les reçoive avec un certain décalage, qui est proportionnel à la distance. Si le nerf est assez hétérogène, son potentiel d’action global pourra prendre une forme multimodale, en relation avec son spectre de diamètres (fig. 10).C’est en constatant ce fait et en l’interprétant correctement que, en prenant le raisonnement dans l’autre sens, les Américains H. S. Gasser et J. Erlanger firent les premiers (1927) la preuve de l’existence d’une relation diamètre-vitesse. À une époque où les microtechniques de recueil de l’activité élémentaire n’étaient pas encore au point, cette preuve ainsi que la vérification d’une hypothèse sur la forme de la relation ne pouvaient être données que par des essais de reconstruction d’un potentiel d’action global à partir de ses composantes convenablement décalées. Plusieurs auteurs, H. S. Gasser et H. Grundfest (1939), J. B. Hursh (1939), entre autres, s’y employèrent avec succès.Le résultat de ces laborieuses analyses est d’autant plus intéressant qu’il conduisit à un classement des fibres en catégories présentant certains rapports avec les fonctions que les nerfs assument (fig. 11). On distingue tout d’abord trois grands types de fibres: A, B, C. Les fibres A myélinisées, catégorie très étendue au point de vue fonctionnel, comprennent, en effet, tous les afférents de la sensibilité cutanée et de la sensibilité musculaire, ainsi que les efférents de la motricité squelettique; les fibres B, également à myéline, sont les fibres préganglionnaires du système sympathique; les fibres C, amyéliniques, se divisent en deux groupes, les Cs (efférents postganglionnaires du système sympathique) et les Cr (qui accompagnent les afférents cutanés II et III dans les racines postérieures de la moelle). Le tableau 1 donne quelques-unes des caractéristiques différentielles des fibres A, B et C.Si l’on part maintenant de la grande distinction fonctionnelle entre sensibilité et motricité, on retrouve ces catégories avec des subdivisions par ordre de vitesses décroissantes, notées différemment (tabl. 2) selon Gasser (alphabet grec) ou Lloyd (chiffres romains).Les fibres des nerfs sensoriels spécialisés (nerfs optique, auditif, vestibulaire, olfactif) ne rentrent pas dans ces catégories. Il en est de même pour les voies nerveuses de la moelle et de l’encéphale.4. Le neurone, vecteur d’informationDans son rôle de vecteur d’information, le neurone considéré isolément n’est qu’un intermédiaire, de telle sorte que le problème ne saurait être abordé ici dans son ensemble (cf. CYBERNÉTIQUE - Cybernétique et biologie; SYNAPSES).La figure 12 présente schématiquement le neurone comme un système entrée-sortie, capable de coder, sous forme de trains d’impulsions de fréquence variable, l’intensité du niveau de l’excitation qui se totalise à chaque instant à son pôle récepteur. Les trains sont ensuite conduits sans altération par l’axone jusqu’à ses terminaisons ramifiées où se distribue l’information à un nombre plus ou moins grand d’autres neurones.En supposant que chaque impulsion soit isolément capable d’une opération sélective à son point d’impact (un bit par pointe), le débit maximal possible de la ligne pourrait être de quelques centaines de bits par seconde; mais l’incrément T de l’intervalle T entre deux pointes successives est probablement un symbole élémentaire de codage plus significatif, dans la mesure où il dépasse le niveau de son bruit. En prenant, pour ce dernier, 梁 0,05 ms, Mc Kay et Mc Culloch ont calculé un débit maximal de 2 900 bits/s. En appliquant leur formule à des trains de fréquence moyenne 100, on obtient 1 500 bits/s, soit 15 bits par impulsion, pour le nombre des opérations sélectives possibles au cours des opérations réalisées ensuite dans les centres nerveux.
Encyclopédie Universelle. 2012.
